本文將從關鍵臨床試驗設計策略、療效與安全性、劑型創新的維度,解析酮洛芬貼劑的臨床價值與市場潛力,揭示其在百億級OA治療市場中的突破性進展。
2019年,全球約5.3億骨關節炎患者正在經歷"沉默的疼痛風暴"!作為最常見的退行性肌骨系統疾病,我國骨關節炎標化患病率高于亞洲平均水平,龐大的人口基數與老齡化趨勢,患者負擔將進一步加重[1]。傳統口服NSAIDs雖能短暫緩解癥狀,卻暗藏致命隱患,36%的長期使用者可能面臨消化道出血、心腦血管事件等系統性風險。酮洛芬貼劑通過局部透皮給藥,顯著降低全身暴露量,系統性風險顯著降低,成為國內外權威指南推薦的鎮痛藥物。
1??療效顯著:原研藥酮洛芬貼劑(商品名MOHRUS®)III期臨床研究顯示[2],酮洛芬貼劑治療慢性疼痛疾病的改善率達95%以上,與其他貼膏貼劑相比,鎮痛效果更優,且起效快、持續時間長。
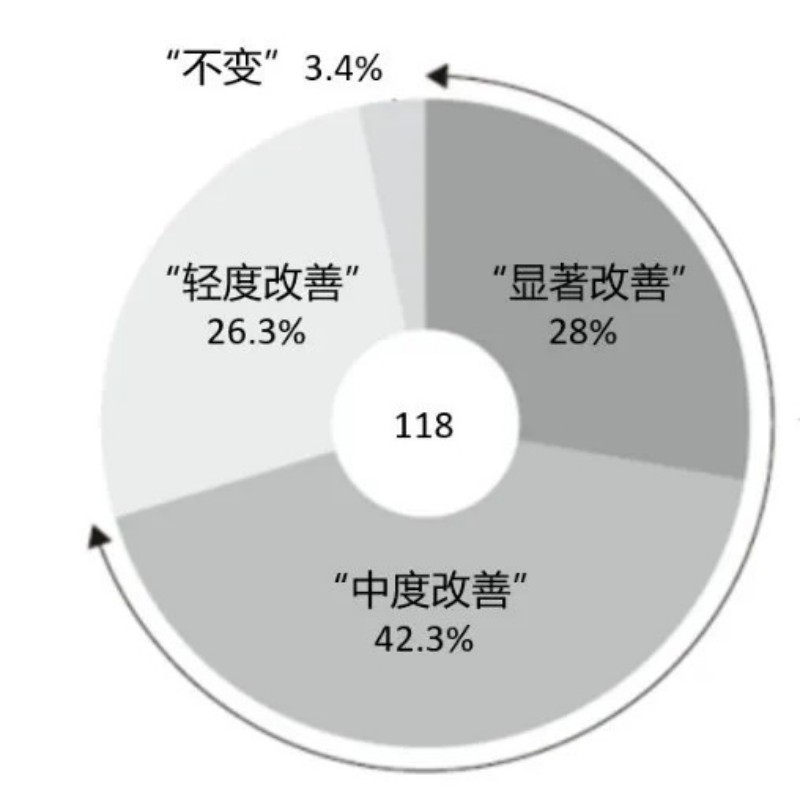
MOHRUS®治療慢性疼痛疾病療效的原研數據
2??安全性突出:其安全性數據表明,主要不良反應為局部皮膚反應,如皮疹、瘙癢等,發生率低[2]。3??適應癥廣泛:覆蓋類風濕性關節炎、骨關節炎、肩周炎、肌肉痛、扭傷等多種疼痛場景,滿足多科室臨床需求。
市場前景:百億藍海與本土化機遇
1??精準切入慢性疼痛剛需市場:慢性疼痛疾病的發病率不斷上升,酮洛芬貼劑以局部給藥方式實現非侵入性靶向鎮痛,兼具高效與安全雙重屬性,直擊患者“少副作用、便捷控痛”的核心訴求,市場滲透率持續提升。
2??政策賦能OTC市場擴容:CDE批準酮洛芬貼劑轉為非處方藥,打破處方壁壘。患者可自主通過線上線下多渠道即時購藥,尤其利好骨關節炎等需長期鎮痛管理的患者群體,預計將帶動國內零售終端銷量爆發式增長。
3??新興市場與出口雙輪驅動:亞太、拉美等新興市場慢性病負擔加重,本土化醫療需求激增,中國藥企可依托產能與技術優勢,同步開拓國內外增量市場。
臨床路徑:化藥3類的臨床設計核心
目前國內僅有貴州聯盛藥業有限公司的酮洛芬貼片獨家上市,多家企業處于臨床研發階段,河北一品制藥股份有限公司、內蒙古白衣制藥股份有限公司、深圳琺瑪易藥品科技有限公司、湖南九典制藥股份有限公司等企業提交了3類仿制藥申請臨床,均在審評審批中。此外,湖南九典制藥股份有限公司已完成BE試驗、III期臨床試驗,進度領先;河北一品制藥股份有限公司BE試驗進行中;深圳琺瑪易藥品科技有限公司III期臨床試驗進行中。
酮洛芬貼劑注冊分類為化藥3類,基于國家藥監局發布的《皮膚外用化學仿制藥研究技術指導原則》、《局部給藥局部起效藥物臨床試驗技術指導原則》等相關指導原則,3類仿制藥需要驗證其在中國人群中的有效性及安全性,同時考慮與參比制劑的生物等效性。目前登記公示公布的臨床設計核心如下:
√湖南九典制藥股份有限公司:通過PK-BE研究驗證酮洛芬貼劑的生物等效性,III期臨床試驗采用陽性藥/安慰劑平行對照的三臂試驗,以已上市的LOXONIN®TAPE(洛索洛芬鈉貼劑)為陽性對照,通過非劣效性設計驗證療效與安全性。
√深圳琺瑪易藥品科技有限公司:III期臨床試驗采用參比制劑(MOHRUS®)/安慰劑平行對照的三臂試驗,通過等效性設計驗證療效一致性。

圖源:摩熵醫藥數據庫
參考國內同類產品大臨床試驗,酮洛芬貼劑的臨床設計關鍵指標如下:√對照組:均設計安慰劑對照驗證其療效的優效性;陽性藥選擇已上市的產品如氟比洛芬凝膠貼膏、洛索洛芬鈉凝膠貼膏等,或選擇參比制劑驗證其療效的一致性;
√有效性指標:以VAS評分改善為核心,聯合功能評價量表(WOMAC);
√安全性指標:重點評價局部皮膚刺激性、全身不良反應等;
√樣本例數:400-500例。
目前已登記臨床試驗存在設計差異,其生物等效性評價包括藥代動力學研究(PK-BE)、臨床終點生物等效性研究,后續品種獲批進展我們拭目以待。
關于晶易醫藥臨床
晶易醫藥臨床團隊擁有1300+項BE/I~III期/IIT研究經驗,尤其在透皮制劑臨床研究領域具備突出的優勢。團隊不僅完成了多款外用非甾體抗炎藥的等效性研究,更推動酮洛芬貼劑、酮洛芬凝膠貼膏、吲哚美辛凝膠貼膏等市場熱門產品挺進III期臨床。公司在臨床進度上的領先優勢,可以為酮洛芬貼劑的商業化加速鋪路。
參考文獻:
[1].WU Haotian,LIN Jianhao.Disease Burden and Harm of Osteoarthritis[J].Medical Journal of Peking Union Medical College Hospital,2025,16(1):5-12.
[2].MOHRUS®TapesL IF文件,久光製薬株式會社,2023年12月修訂(第18版).


